- 1.70 MB
- 2022-04-22 13:47:06 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn离子交换树脂法分离纯化赖氨酸的研究**司文青,魏顺安,王丹(重庆大学化学化工学院,重庆400030)5摘要:文章为课题组新型菌株发酵生产赖氨酸进行下游分离工艺的研究,采用工业上最常用的离子交换树脂法,以最优的树脂、最佳的吸附解吸条件和经济性为目标,探究了赖氨酸发酵分离的工艺数据,主要分析了离子交换分离赖氨酸的静态和动态吸附原理及过程。文章对所选的7种树脂进行了筛选,分别探究了001×7型树脂静态、动态吸附赖氨酸的影响因素。10关键词:离子交换树脂分离法,001×7型树脂,静态吸附,动态吸附,最优条件中图分类号:TQ028.8StudyontheSeparationofLysineUsingIonExchangeResin15SIWenqing,WEIShunan,WANGDan(SchoolofChemistryandChemicalEngineering,ChongqingUniversity,Chongqing400030,China)Abstract:Inthispaper,adownstreamseparationprocessoflysinewasstudied,whichwasfermentedbyanewtypeoflab-madebacterialstrain.Themostcommonlyusedion-exchangeresinmethodwas20adopted.Theprocessdataoflysineseparationwasexploredforthetargetofchoosingbestresin,thebestadsorptionanddesorptionconditionsandeconomicalefficiency.Finally,thestaticanddynamicadsorptionprincipleandprocessofionexchangeseparationoflysinewereanalyzed.Sevenkindsofresinswerescreened,andtheinfluencingfactorsofstaticanddynamicadsorptionoflysineby001×7resinwereinvestigated.25Keywords:Ion-exchangeresinmethod;001×7resin;Staticadsorption;Dynamicadsorption;Optimumcondition0引言30赖氨酸是人体必需氨基酸之一,能促进人体发育、增强免疫功能,并有提高中枢神经[1]组织功能的作用,被广泛应用于食品、医药、饲料等诸多领域,市场需求逐年增大。其中,[2]全球约90%的赖氨酸用作饲料添加剂,约5%用作食品添加剂,其余5%用作医药中间体。目前,大工业生产中,主要使用发酵法生产赖氨酸,工艺成熟,可以通过人为地控制[3,4]发酵条件,改变缺陷型菌株或变异菌株的代谢途径,显著增加产酸量。酶解法也有应用,[5]35而水解法和合成法,因原料来源有限,应用较少。发酵液中氨基酸的分离提取一直是氨基[6]酸生产过程中的一个技术难点,对此,业内学者一直在进行研究。现有的氨基酸分离工艺主要有沉淀法,萃取法,电渗析法,膜分离法和离子交换吸附法。随着科技的进步和技术要求的提高,氨基酸的分离需要更高的分离效果和更好的经济、环保效益。目前工业生产中,[7-9]离子交换法应用最为广泛。作者简介:司文青(1992-),女,硕士,主要研究化工过程分离通信联系人:王丹(1982-),女,副教授,硕导,生物催化和代谢工程,主要开展:1、以具有生物活性的酶和全细胞作为催化剂,以可再生生物质为原料的生物催化研究;以生物转化的过程优化为主要研究对象。此外,还开展从头设计的代谢途径研究,计算机模拟技术和湿实验相结合构建细胞工厂。2、天然产物和蛋白分离纯化:利用膜分离、吸附及离子交换、亲和色谱等技术,开展天然产物、基因工程药物、酸等的分离工艺及作用机制研究,实现多种生物活性物质的分离纯化如,白藜芦醇、琥珀酸、蛋白A,重组人粒细胞集落刺激因子,重组人上表皮生长因子等的分离纯化.E-mail:dwang@cqu.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn40离子交换树脂吸附分离赖氨酸的基本原理是碱性氨基酸赖氨酸在酸性条件下,可以形成赖氨酸盐,其与铵型阳离子交换树脂进行离子交换,被吸附在树脂上,从而与非碱性氨基[1]酸、葡萄糖、蛋白质等有机杂质分开;随后用氨水进行洗脱,结晶后得到赖氨酸成品。本实验旨在为课题组新型菌株发酵生产赖氨酸进行下游分离工艺的研究,采用工业上最常用的离子交换法,用铵型强酸性离子交换树脂做吸附剂,氨水做洗脱剂,探究赖氨酸发45酵分离的工艺流程数据,为工艺设计提供参考,也可为现有分离技术的改造提供数据参考。1实验部分1.1原料与试剂L-赖氨酸,上海源叶生物科技有限公司;氨水,葡萄糖,浓盐酸,氢氧化钠,茚三酮(一水),柠檬酸(一水),氯化铜(二水),乙二醇甲醚,醋酸钠(三水),乙腈,冰醋酸,50四氢呋喃,硼酸,邻苯二甲醛,甲醇,巯基乙醇,异丙醇,均来自成都市科龙化工试剂厂。001×7型树脂,001×14.5型树脂,D101型树脂,D61型树脂,D72型,来自天津波鸿树脂科技有限公司;C106型树脂,C108型树脂,来自杭州争光树脂有限公司。1.2实验过程1.2.1树脂的筛选55树脂使用前,先用去离子水冲洗除去悬浮杂质,然后浸泡24h使之充分溶胀,再用氨水将树脂预处理成铵型保存在去离子水中;称取5.0g湿树脂于干燥的250mL锥形瓶中,加入一定浓度、一定体积的赖氨酸溶液,在一定温度、100-150r/min条件下恒温一定时间;反应结束后,用1mL移液枪移取上清液,测上清液浓度,此为吸附平衡浓度Ce,并计算树脂吸附能力;利用漏斗、真空泵和布氏漏斗,过滤吸附了酸的树脂,并用去离子水冲洗10EB体60积后,加入一定浓度、一定体积的洗脱液(氨水),在一定温度、100-150r/min条件下恒温一定时间,取洗脱液,测浓度Cd,计算解吸率。[10]静态吸附能力和静态解吸率的计算式如下:QVCCW=−()/(1)ee00D=−CVdd/(C00CVe)(2)65其中,Qe(g/g)为吸附能力,C0、Ce(g/L)分别指赖氨酸溶液的初始浓度和平衡浓度,V0(mL)为加入样品液单位体积,W(g)指加入树脂的湿重;D为解吸率(%),Cd为洗脱液中赖氨酸的浓度(g/L),Vd为洗脱液用量。根据以上实验步骤和计算方法,分别计算7种树脂对赖氨酸和葡萄糖的吸附能力和解吸率,对比筛选出最优树脂。701.2.2静态实验条件的优化(1)静态吸附条件的优化实验称取5.0g预处理过的树脂若干份于250ml的锥形瓶中,分别加入一定体积、一定pH的5g/L赖氨酸溶液,在25℃下于恒温振荡器中振荡一定时间,取样测定溶液中赖氨酸的浓度,并计算平衡吸附量。-2-
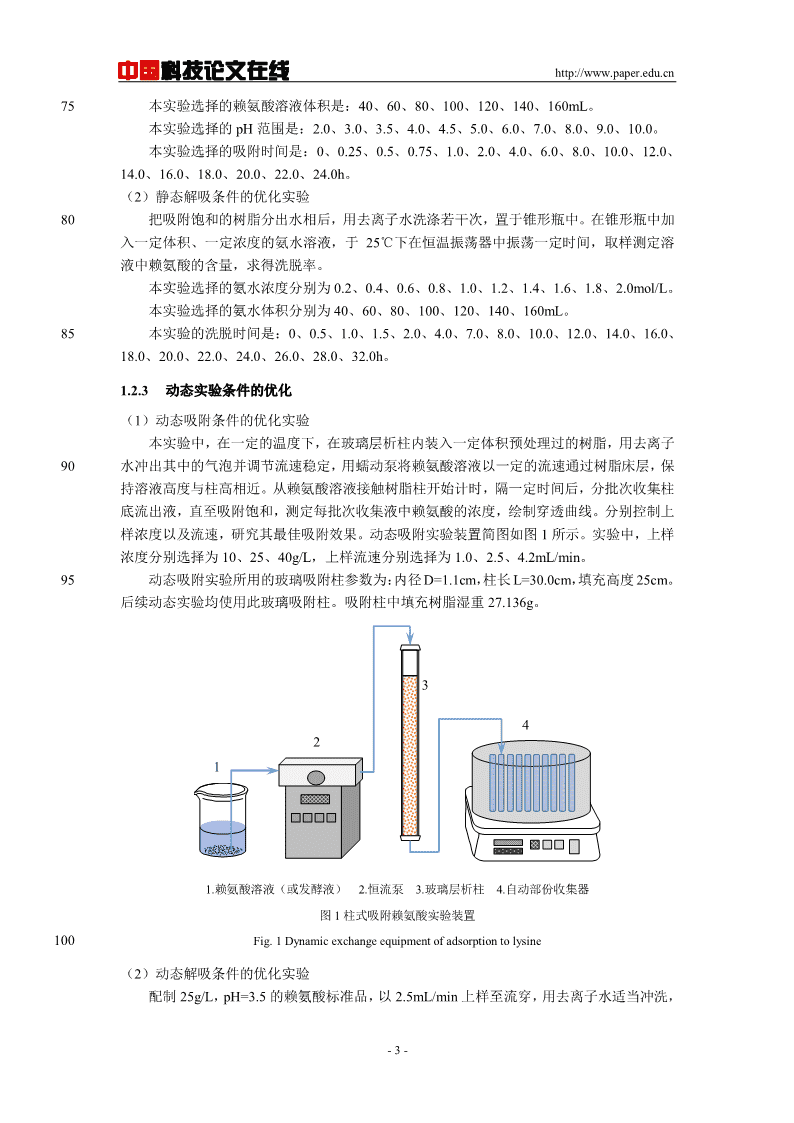
中国科技论文在线http://www.paper.edu.cn75本实验选择的赖氨酸溶液体积是:40、60、80、100、120、140、160mL。本实验选择的pH范围是:2.0、3.0、3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0、10.0。本实验选择的吸附时间是:0、0.25、0.5、0.75、1.0、2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0、22.0、24.0h。(2)静态解吸条件的优化实验80把吸附饱和的树脂分出水相后,用去离子水洗涤若干次,置于锥形瓶中。在锥形瓶中加入一定体积、一定浓度的氨水溶液,于25℃下在恒温振荡器中振荡一定时间,取样测定溶液中赖氨酸的含量,求得洗脱率。本实验选择的氨水浓度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0mol/L。本实验选择的氨水体积分别为40、60、80、100、120、140、160mL。85本实验的洗脱时间是:0、0.5、1.0、1.5、2.0、4.0、7.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0、22.0、24.0、26.0、28.0、32.0h。1.2.3动态实验条件的优化(1)动态吸附条件的优化实验本实验中,在一定的温度下,在玻璃层析柱内装入一定体积预处理过的树脂,用去离子90水冲出其中的气泡并调节流速稳定,用蠕动泵将赖氨酸溶液以一定的流速通过树脂床层,保持溶液高度与柱高相近。从赖氨酸溶液接触树脂柱开始计时,隔一定时间后,分批次收集柱底流出液,直至吸附饱和,测定每批次收集液中赖氨酸的浓度,绘制穿透曲线。分别控制上样浓度以及流速,研究其最佳吸附效果。动态吸附实验装置简图如图1所示。实验中,上样浓度分别选择为10、25、40g/L,上样流速分别选择为1.0、2.5、4.2mL/min。95动态吸附实验所用的玻璃吸附柱参数为:内径D=1.1cm,柱长L=30.0cm,填充高度25cm。后续动态实验均使用此玻璃吸附柱。吸附柱中填充树脂湿重27.136g。34211.赖氨酸溶液(或发酵液)2.恒流泵3.玻璃层析柱4.自动部份收集器图1柱式吸附赖氨酸实验装置100Fig.1Dynamicexchangeequipmentofadsorptiontolysine(2)动态解吸条件的优化实验配制25g/L,pH=3.5的赖氨酸标准品,以2.5mL/min上样至流穿,用去离子水适当冲洗,-3-
中国科技论文在线http://www.paper.edu.cn然后将一定量的1mol/L氨水以一定的速度流经饱和树脂层,分批次收集柱底洗脱液,并测定每批次洗脱液中赖氨酸浓度,绘制动态洗脱曲线。实验中,洗脱流速分别选择为1.0、2.5、1054.2mL/min。1.3分析测试方法1.3.1OPA柱前衍生高效液相色谱法测定赖氨酸含量(1)实验原理由于赖氨酸没有荧光响应,为提高分析检测的灵敏度和分离选择性,先将赖氨酸衍生化,110接上发光或发色基团,再进行定性定量分析。邻苯二甲醛,o-phthaldialdelhyde,简称OPA,在具有还原性物质(如3-巯基丙酸或2-巯基乙醇)存在时,能与一级氨基酸迅速反应生成具有很强荧光的异吲哚衍生产物1-巯代-2-[11]烷基-异吲哚,使衍生物具有苯环,从而可采用紫外检测器进行检测。该反应在室温下1min即可完成。具体反应方程如图2所示。115图2氨基酸与邻苯二甲醛反应Fig.2AcidaminoreactionwithOPA(2)溶液的配制0.4mol/L硼酸缓冲液:精密称取2.4732g硼酸,用少量水溶解后,再用10%NaOH溶液120调节pH至9.5,最后定容至100mL。OPA衍生试剂:精密称取50mg邻苯二甲醛,用1mL甲醇溶解,再加入0.5mL巯基乙醇,最后用0.4mol/L的硼酸缓冲液定容至10mL,现配现用,冷藏保存。有机相A:精密称取2.7216g三水醋酸钠固体,加水溶解,定容至200mL,将此溶液与乙腈按1:4体积比混合,超声脱气,备用。125无机相B:精密称取4.0824g三水醋酸钠固体,加入900mL水溶解后,用冰醋酸调pH至6.5,再加入3mL四氢呋喃,最后用水定容至1000mL,超声脱气,备用。氨基酸标准液:精密称取标准赖氨酸各0.25、0.5、1.0、2.0、3.0、4.0、6.0、8.0、10.0、16.0mg,用0.4mol/L的硼酸缓冲液定容至10mL,制得0.025、0.05、0.1、0.2、0.3、0.4、0.6、0.8、1.0、1.6mg/mL的赖氨酸标准液,冷藏保存。130(3)衍生方法移取500µL赖氨酸标准液或样品于1mL离心管中,然后加入500µLOAP衍生化溶液,混合均匀,反应2min,用0.45μm滤膜将样液过滤,立即取20µL反应液进样,进行色谱分析。(4)色谱条件135经查阅文献和多次条件优化,最终设定高效液相色谱条件如表1所示。2按照上述方法绘制赖氨酸标准曲线,得到拟合曲线方程为y=18.34284x–0.19669,R=-4-
中国科技论文在线http://www.paper.edu.cn0.99963,赖氨酸浓度在0-0.8mg/mL范围内线性关系成立,所以后续测定样品浓度时需进行适当稀释。表1高效液相色谱检测条件140Tab.1TestingconditionsofHPLC时间流速流动相柱温波长(min)(mL/min)有机相A(%)无机相B(%)(℃)(nm)030702.040604.050501.0353386.0604010.0703012.08020色谱柱:AglientEclipseAAA(4.6*150mm,5µm)1.3.2高效液相示差法测定葡萄糖含量(1)溶液的配制称取标准葡萄糖各5.0、10.0、20.0、40.0、80.0、160.0mg,用蒸馏水定容至10mL,制145得0.5、1.0、2.0、4.0、8.0、16.0mg/mL的葡萄糖标准液,用0.45μm滤膜将样液过滤,供液相色谱测定。[12,13](2)色谱条件经查阅文献和多次条件优化,最终设定高效液相色谱条件如下:色谱柱为C18柱(4.6mm×250mm);柱温35℃;流动相为乙腈-水(体积比为75:25)溶液,使用前用0.45μm150滤膜抽滤;流速1.0mL/min;进样量20μL。2按照上述方法绘制葡萄糖标准曲线,得到拟合曲线方程为y=1.22677x+0.15485,R=0.99907。2结果与讨论2.1树脂筛选结果1552.1.1吸附解吸赖氨酸表2中列出了七种树脂对赖氨酸的静态吸附实验结果。实验结果表明,树脂001×7、001×14.5、D072的吸附量和解吸效果均不错,他们的吸附量分别达到0.0751、0.0744、0.0571g/g,解吸率分别为96.33%、91.71%、98.33%。而树脂D101和C108的吸附能力和解吸效果均较弱,可以初步排除。160表2吸附解吸赖氨酸树脂性能Tab.2Screeningofabsorbentsforlysineseparation树脂类型含水量(%)A(g/g)D(%)LALA001×7苯乙烯系520.075196.33-5-
中国科技论文在线http://www.paper.edu.cn001×14.5苯乙烯系800.074491.71D101苯乙烯系750.030654.05D061苯乙烯系520.028574.21D072苯乙烯系550.057198.33C106丙烯酸系800.036192.54C108丙烯酸系750.034156.98表中,ALA指树脂对赖氨酸的吸附量,DLA指树脂对赖氨酸的解吸率。2.1.2吸附解吸赖氨酸[10]除吸附量之外,吸附选择性是吸附过程另一个重要指标。发酵液中含有大量的营养165物质,如残余的碳源和氮源,包括其他氨基酸、蛋白质和葡萄糖。所以,还需测试树脂对葡萄糖的吸附作用,树脂对赖氨酸和葡萄糖的竞争吸附作用结果如表3所示。七种树脂对葡萄糖均有不同程度的吸附作用,D001、D061对葡萄糖吸附能力较好,解吸率很低。001×7、001×14.5对葡萄糖解吸效果很好。根据已有文献描述,酸糖吸附比大于4的树脂专一性性能较好。其中,树脂001×7、001×14.5、C106符合条件,虽然C106选择170性最高,但是其对赖氨酸的吸附能力很弱。而树脂001×7不仅对赖氨酸的吸附量和解吸效果均不错,对葡萄糖也基本没有保留行为,可以被水从树脂上冲洗下来。所以,综合比较七种树脂吸附解吸赖氨酸/葡萄糖的能力,最终选择001×7型离子交换树脂进行赖氨酸吸附的后续研究。表3吸附解吸葡萄糖树脂性能175Tab.3Selectivityoflysinetowardsglucose树脂A(g/g)D(%)A(g/g)A/AGGLALAG001×70.006698.210.075111.38001×14.50.00951000.07447.83D0010.010434.330.03062.94D0610.010022.650.02852.85D0720.009875.220.03713.78C1060.001121.390.036132.82C1080.008788.870.03413.92表中,AG为树脂对葡萄糖的吸附量,DG为树脂对葡萄糖的解吸率,ALA/AG为树脂对赖氨酸和葡萄糖的吸附选择性。-6-
中国科技论文在线http://www.paper.edu.cn2.2静态实验结果2.2.1单因素实验优化结果180静态实验中,对于吸附过程,主要探究了赖氨酸溶液体积、初始pH和吸附时间对树脂吸附能力的影响;对于解吸过程,主要探究了洗脱液浓度、洗脱液体积和洗脱时间对树脂解吸率的影响,从而得到了最佳的静态实验条件。(1)赖氨酸溶液体积对吸附能力的影响离子交换树脂与赖氨酸以离子间力结合,反应在液相接触的界面和固态树脂之间进行。185树脂的功能基团解离出能够交换的离子,通过自由移动扩散至溶液中,与赖氨酸进行离子交换。赖氨酸溶液用量的多少决定溶液中可交换离子的数量,用量多则交换过程较快、吸附量大。图3给出了不同赖氨酸溶液体积对树脂吸附量的影响,由此得到最佳的赖氨酸溶液体积。由图3可知,发酵液体积在40mL-100mL之间,随着发酵液用量增多,体系中能够与树脂解离出的可交换离子产生交换过程的赖氨酸增多,离子之间的交换过程迅速进行,吸附190量逐渐增大。当发酵液体积为100mL时,吸附量最高为0.085g/g,此时溶液中的离子交换反应达到动态平衡。继续增大发酵液用量,由于树脂中交换基团的数量有限,吸附能力保持一定水平不再增大。所以,选择最佳赖氨酸溶液体积为100mL。图3赖氨酸溶液体积对树脂001×7吸附能力的影响195Fig.3Effectofsolutionvolumeontheadsorptioncapacityof001×7(2)pH对吸附能力的影响如图所示,pH对离子交换树脂的吸附过程影响突出。在低pH(pH=2-4.5)条件下,树脂对赖氨酸的吸附性能更好,在pH值为4.5时可以达到0.086g/g湿树脂以上;中性条件下吸附量降低,只有0.045g/g湿树脂左右。200这主要是因为在不同pH条件下,赖氨酸会以不同离子状态存在,而离子形态会对强酸性阳离子交换树脂的吸附能力及选择性产生影响。赖氨酸溶液pH值在4.0-6.0范围内,赖氨+2+酸主要以Lys形态存在,随着溶液pH的降低,Lys比例增加;赖氨酸溶液pH在6.0以上0-[14]时,Lys和Lys开始占较大比例。由图4知,当初始pH在2-4.5时,树脂的吸附能力相差不大,但是pH越低,调节pH-7-
中国科技论文在线http://www.paper.edu.cn205所需的酸、碱消耗量越大;而且对发酵液来说,若发酵清液pH值过低,清液中的其它氨基酸也会带正电荷,形成竞争吸附,不利于赖氨酸与其它氨基酸的分离。当清液pH值过高时,0-0-溶液中会有Lys和Lys存在,Lys和Lys不能与强酸性阳离子交换树脂进行离子交换,使吸附能力降低。而且,在中性或碱性条件下,离子交换树脂处理成-NH4型,交换基团与赖++氨酸离子进行交换后,置换出NH4形式的碱盐,随着浓度的增加,NH4形式的碱盐可以发210挥洗脱剂的作用,限制了树脂的吸附量。所以,综上所述,当pH值为3.5-4.5时,对树脂吸附过程最有利。图4pH值对树脂001×7吸附能力的影响Fig.4EffectofpHvalueontheadsorptioncapacityof001×7215(3)吸附时间对吸附能力的影响图5为吸附时间对001×7树脂吸附赖氨酸的影响曲线。从图中可以看出,反应时间在1.5h内,树脂对赖氨酸的吸附量几乎呈线性增长,并最终在2h左右达到吸附平衡;12h之后随着时间推移,发生少量解吸。在吸附的初期由于内外浓度差大,吸附过程进行的推动力大,吸附速率也大,随着吸附接近平衡,后期的吸附速率就变慢。随着反应时间的延长,树220脂上的铵基逐渐减少,则树脂对赖氨酸的吸附效果再无明显改善。所以,选择最佳吸附时间为2h。-8-
中国科技论文在线http://www.paper.edu.cn图5吸附时间对树脂001×7吸附能力的影响Fig.5Effectoftimeontheadsorptioncapacityof001×7225(4)氨水浓度对解吸率的影响洗脱是吸附分离过程的重要步骤,选择合适的洗脱液浓度对分离后的回收率有重要的影响。如图6所示,随着氨水浓度的增大,赖氨酸的解吸率逐渐上升,当氨水浓度大于0.8mol/L,解吸率均可以达到90%以上。氨水浓度达到1.6mol/L时,解吸率可达98.1%,继续增加氨水浓度,解吸率有所降低。为了在满足分离效果的前提下节省洗脱液用量,选用1.0mol/L230作为氨水解吸液的浓度。图6洗脱液浓度对解吸率的影响Fig.6Effectofammoniaconcentrationonthedesorptionoflysine(5)氨水体积对解吸率的影响235当氨水浓度一定时,其用量越大,解吸动力越大,解吸效果也就越好。但是氨水用量-9-
中国科技论文在线http://www.paper.edu.cn太大时,影响了整个体系的离子交换过程。图7为氨水体积对赖氨酸解吸率的影响曲线。由图可以看出,氨水体积由40mL逐渐增加到120mL时,解吸率随之增大,100mL和120mL时解吸率基本持平,最大可达到96%左右。继续增大氨水体积,解吸率反而随之下降,同时也造成洗脱剂的浪费。所以选择最佳的解吸液体积为100mL。240图7洗脱液体积对解吸率的影响Fig.7Effectofammoniavolumeonthedesorptionoflysine(6)洗脱时间对解吸率的影响图8为洗脱时间对赖氨酸解吸率的影响曲线。从图中可以看出,反应时间在2h内,氨245水对赖氨酸的解吸率几乎呈线性增长,并最终在4h左右达到解吸平衡。随着解吸时间的延长,解吸时间对离子交换过程基本没有多大影响,解吸率几乎不再随时间的延长而增大。所以,最佳解吸时间选择为4h。图8解吸时间对解吸率的影响250Fig.8Effectoftimeonthedesorptionoflysine-10-
中国科技论文在线http://www.paper.edu.cn2.2.2静态平衡吸附等温线等温吸附线是用来描述达到吸附平衡时,溶液中的吸附质与吸附剂所吸附的吸附质之间的关系的曲线。它能够很好的描述和解释吸附过程,因此针对不同情况,人们提出了不同的吸附等温模型。255准确称取5.000g预处理过的树脂若干份于250ml的锥形瓶中,分别加入100ml一系列浓度梯度或pH梯度的赖氨酸溶液,置于恒温摇床中,140r/min,吸附24h达到平衡后,测定吸附后溶液中赖氨酸浓度,计算等温曲线方程。本实验采用了两种应用最广泛的等温线模[15][16]型,Freundlich模型和Langmuir模型来描述和解释树脂吸附赖氨酸的过程。①Freundlich模型260Freundlich模型广泛应用于物理及化学吸附过程,它既可以用来描述单分子层吸附,又可用来描述多分子层吸附过程。Freundlich模型方程如下所示:1/nQKC=⋅(3)eFe其中,Qe为平衡时的吸附量(g/g),Ce为平衡时溶液中的浓度(g/L),KF和n是与吸附能力和吸附强度有关的Freundlich常数,反映了体系的吸附特性。n可判断反应的难易265程度,n大于1时表明吸附反应容易进行。对方程(3)两边取对数,则方程转化为线性方程:InQeF=+InK(1/)nInCe(4)lnQe对lnCe作图,则lnKF和1/n通过线性回归方程的斜率和截距计算得出。②Langmuir模型270Langmuir模型用于描述单分子层吸附过程,它假设被吸附的分子间没有相互作用,吸附剂表面均匀,吸附能力处处相等,吸附热不随吸附程度而变。Langmuir模型方程如下所示:QKQC=⋅⋅/(1+KC)(5)eL0eLe其中,Qe为平衡时的吸附量(g/g),Ce为平衡时溶液中的浓度(g/L),Q0为单分子层吸275附的理论饱和吸附能力(g/g),KL为与吸附亲和力相关的Langmuir常数(1/g)。对方程(5)两边取倒数,则方程转化为线性形式:CQCQ//=+⋅1/KQ(6)eee00L以Ce/Qe对Ce作图,则Q0和KL通过线性回归方程的斜率和截距计算得出。(1)温度对平衡吸附等温线的影响-11-
中国科技论文在线http://www.paper.edu.cn280图9温度对平衡吸附等温线的影响Fig.9Effectoftemperatureontheadsorptionisothermof001×7如图9显示不同温度下的001×7型离子交换树脂对赖氨酸的吸附等温线,从图中可以看出吸附能力随着温度的上升而下降。为了进一步说明树脂001×7对赖氨酸的等温吸附过程,285对不同温度下的等温线与Freundlich模型和Langmuir模型进行线性拟合,如图10、11所示。图10不同温度下吸附平衡等温线的Freundlich模型线性拟合Fig.10ModelingwithFreundlichequationatdifferenttemperature-12-
中国科技论文在线http://www.paper.edu.cn290图11不同温度下吸附平衡等温线的Langmuir模型线性拟合Fig.11ModelingwithLangmuirequationatdifferenttemperature表4不同温度下吸附平衡等温线的Freundlich模型和Langmuir模型线性拟合回归方程295Tab.4SimulatedFreundlichandLangmuirequationsatdifferenttemperatureFreundlich方程2T(K)lnQe=lnK+(1/n)lnCeKF1/nRF291lnQe=-2.82167+0.44935lnCe0.059510.449350.97601298lnQe=-3.02766+0.46490lnCe0.048430.464900.98667310lnQe=-3.22022+0.47416lnCe0.039950.474160.98645Langmuir方程2T(K)Q(g/g)K(g/g)RCe/Qe=Ce/Q+1/K·Q0L0L0291Ce/Qe=5.63499+7.29145Ce0.137151.293960.99551298Ce/Qe=7.79282+7.47666Ce0.133750.959430.99687310Ce/Qe=9.91731+7.69047Ce0.130030.775460.99658从图中可以看出Langmuir模型比Freundlich模型的拟合线性更好。进一步通过线性回归方程,计算得到不同温度下的Freundlich常数和Langmuir常数,如表4所示,Langmuir方程的相关系数比Freundlich方程的相关系数更接近1。因此,整个吸附过程更加符合Langmuir等温吸附过程,属于单分子层吸附。300Langmuir理论中,Q0代表吸附剂的吸附能力,因此001×7树脂对赖氨酸的吸附能力随着温度的升高而下降。这可能是因为吸附过程属于放热过程,升高温度不利于吸附过程;而且赖氨酸在水中的溶解度随着温度的上升而上升,因此赖氨酸与树脂之间的亲和力相对下降。(2)pH对平衡吸附等温线的影响-13-
中国科技论文在线http://www.paper.edu.cn305图12pH对平衡吸附等温线的影响Fig.12EffectofpHontheadsorptionisothermof001×7如图12显示不同初始pH下的001×7型离子交换树脂对赖氨酸的吸附等温线,吸附能力随着pH的上升而下降。进一步对不同pH下的等温线与Freundlich模型和Langmuir模型310进行线性拟合,如图13、14所示。图13不同pH下吸附平衡等温线的Freundlich模型线性拟合Fig.13ModelingwithFreundlichequationatdifferentpH-14-
中国科技论文在线http://www.paper.edu.cn315图14不同pH下吸附平衡等温线的Langmuir模型线性拟合Fig.14ModelingwithLangmuirequationatdifferentpH表5不同pH下吸附平衡等温线的Freundlich模型和Langmuir模型线性拟合回归方程320Tab.5SimulatedFreundlichandLangmuirequationsatdifferentpHFreundlich方程2pHlnQe=lnK+(1/n)lnCeKF1/nRF2.0lnQe=-2.32597+0.31497lnCe0.097690.314970.966853.5lnQe=-3.05098+0.56119lnCe0.561190.561190.939065.0lnQe=-3.56648+0.57640lnCe0.576400.576400.97608Langmuir方程2pHQ(g/g)K(g/g)RCe/Qe=Ce/Q+1/K·Q0L0L02.0Ce/Qe=5.63499+7.29145Ce0.205122.648830.995273.5Ce/Qe=7.79282+7.47666Ce0.164701.146390.996885.0Ce/Qe=9.91731+7.69047Ce0.088220.917510.99366与不同温度下的等温线相似,各个pH值下的等温曲线Langmuir模型比Freundlich模型的拟合线性要好。因此,改变pH值可以提高吸附能力,但无法改变吸附的类型。通过线性回归方程计算得到不同pH值下的Langmuir常数和Freundlich常数列于表3.4中。可以看出,Langmuir方程的相关系数比Freundlich方程的相关系数更接近1。Langmuir模型中参数Q0325显示,随着pH的降低,吸附量显著增加,这一变化规律也同时说明温度对于吸附能力的影响小于pH值对于吸附能力的影响。降低pH对吸附有利。2.2.3静态吸附动力学准确称取5.000g预处理过的树脂,将其置于250ml的锥形瓶中,分别加入100ml一定浓度和pH值的赖氨酸溶液,置于恒温摇床中,140r/min,以一定时间间隔取样至吸附达到-15-
中国科技论文在线http://www.paper.edu.cn330平衡为止,测定溶液中赖氨酸浓度。进行模拟的吸附动力学模型为:[17]①假一级吸附动力学模型(pseudo-first-orderequation)假一级吸附动力学模型方程如下所示:dQdt/()=−KQQ(7)tet以t=0,Qt=0和t=t,Qt=Qt为边界条件,对方程(7)积分得:335log(QQ−=)logQK−t/2.303(8)etet其中,Qe为平衡时的吸附量(g/g),Qt为时间t时的吸附量(g/g),Kt为假一级的吸-1附速率常数(h)。[18]②假二级吸附动力学模型(pseudo-second-orderequation)假二级吸附动力学模型方程如下所示:2340dQdt/()=−KQQ(9)2et以t=0,Qt=0和t=t,Qt=Qt为边界条件,对方程(9)积分得:2tQ/1=−/KQtQ/(10)te2e-1其中,K2为假二级的吸附速率常数(h)。(1)温度对吸附动力学的影响345图15温度对吸附动力学的影响Fig.15Effectoftemperatureonadsorptionkineticsof001×7如图15是温度对树脂吸附赖氨酸的动力学过程,随着温度的升高,赖氨酸吸附速率加快。这是由于升高温度可以降低溶液的粘度,提高分子的运动速率,促进赖氨酸分子穿过树350脂周围的边界层,加快分子的扩散速率。对不同温度条件下的吸附动力学过程,采用假一级吸附动力学模型和假二级吸附动力学模型进行线性拟合,结果如表6所示。从表中可以看出,假一级吸附动力学模型拟合的相关系数很差,假二级吸附动力学模型不仅具有很好的相关系数,而且其计算出的平衡吸附量与实际实验测量值较吻合,因此在不同的温度条件下,吸附过程符合假二级吸附动力学模型。其特征是同一初始吸附浓度下,增355加温度吸附速率增加,所以310K的饱和吸附量大于298K,但高温下解析速率也加快,所-16-
中国科技论文在线http://www.paper.edu.cn以310K的饱和吸附量低于291K。图3.8中吸附等温线不考虑速率因素,不同初始吸附浓度下的饱和吸附量只与热力学温度相关,离子交换是放热反应,所以降低温度能增加平衡时吸附量。表6不同温度吸附动力学模型拟合参数360Tab.6SimulatedadsorptivekineticsmodelatdifferenttemperaturePseudo-first-orderequationPseudo-second-orderequationT(K)22Qe(g/g)Kt(g/g·h)RQe(g/g)K2(g/g·h)R2910.527450.360720.898230.5465249.24430.999782980.393900.265500.701920.4124138.24120.999913100.441010.338670.799500.4672883.11020.99959(2)pH对吸附动力学的影响图16pH对吸附动力学的影响365Fig.16EffectofpHonadsorptionkineticsof001×7pH值对树脂吸附赖氨酸的动力学过程如图16所示,随着pH的升高,赖氨酸吸附速率减慢。对不同pH条件下的吸附动力学过程,采用假一级吸附动力学模型和假二级吸附动力学模型进行线性拟合,结果如表7所示。由表中可知,在不同pH值条件下,吸附过程符合假二级吸附动力学模型,具有很好的相关系数,而且其计算出的平衡吸附量与实验数据比较370接近。表7不同pH吸附动力学模型拟合参数Tab.7SimulatedadsorptivekineticsmodelatdifferentpHPseudo-first-orderequationPseudo-second-orderequationpH22Qe(g/g)Kt(g/g·h)RQe(g/g)K2(g/g·h)R2.00.326330.265420.783460.2943238.35450.999913.50.263760.335400.854120.1436539.15420.99941-17-
中国科技论文在线http://www.paper.edu.cn5.00.121030.414320.920090.0952231.14320.999822.3动态实验结果3752.3.1单因素实验优化结果(1)不同上样浓度的穿透曲线图17不同上样浓度的穿透曲线Fig.17Effectofconcentrationoflysineonthebreakthroughcurve380配制不同浓度的赖氨酸溶液,pH=3.5,流速为2.5mL/min,检测穿透曲线,如图17所示。由图可以看出,随着上样浓度的增加,穿透曲线斜率逐渐增加。由于在较高的初始上样浓度下,树脂表面的结合位点很快被赖氨酸占据,导致随着上样浓度的上升,穿透时间不断提前。不同上样浓度下的穿透参数如表8所示。由表可知,随着初始浓度的增加,流穿时总吸附量也随之增加,上样体积随之减少;继续增加初始上样浓度,流穿时总吸附量增加的幅385度逐渐平缓,增加不明显。这可能是由于低浓度上样时,溶液中的赖氨酸分子数量相对于树脂表面的离子交换吸附基团数量比较少,穿透吸附量随着浓度上升而增加;而树脂表面的离子交换吸附基团数量是有限的,当赖氨酸分子的数量已经远远超过了树脂表面的离子交换吸附基团数量时,即使在高浓度下再提高浓度,穿透吸附量增加的也不多。表8不同上样浓度下的穿透参数390Tab.8Parametersindifferentconcentration初始浓度上样体积穿透曲线面积总吸附量平衡吸附量C0(g/L)Veff(mL)Aqtotal(g/g)qeq(mg/g)1063025.8495.991220.7982538015.5938.985331.120-18-
中国科技论文在线http://www.paper.edu.cn4024010.7559.099335.307(2)不同上样流速的穿透曲线图18不同上样流速的穿透曲线395Fig.18Effectoftheflowrateoflysineonthebreakthroughcurve由图18可以看出,流速对赖氨酸吸附穿透的影响不如上样浓度显著。随着上样流速的增加,穿透曲线斜率增加,穿透时间随着流速增加而减少。不同上样流速下的穿透参数如表9所示。由表可知,随着流速的降低,达到平衡时的吸附量最大,这是由于在低流速下,赖氨酸分子在柱内停留时间增加,可以更加有效地在树脂孔径内扩散并与树脂充分接触。树脂400的吸附能力随着保留时间的增加而增强,表明树脂的吸附过程是受扩散控制影响,降低流速对吸附过程有利。但是在实际生产中低流速消耗时间过长,在总吸附量相差不大的情况下,应适当提高流速。综上,动态吸附过程最优的上样条件为:上样浓度25g/L-40g/L,上样流速2.5mL/min,上样体积400-500mL。405表9不同上样流速下的穿透参数Tab.9Parametersindifferentflowrate上样流速上样体积穿透曲线面积总吸附量平衡吸附量(mL/min)Veff(mL)Aqtotal(g/g)qeq(mg/g)1.043018.51610.287379.0982.538015.5938.985331.1204.234014.2408.144300.122(3)不同流速的洗脱曲线图19是以洗脱时间为横坐标的洗脱曲线。由图中可以看出,不同的洗脱流速对洗脱过410程的影响不是特别明显,其曲线总趋势一致。洗脱流速越低,洗脱峰相对越集中,洗脱的效-19-
中国科技论文在线http://www.paper.edu.cn果也越好。但是流速太低会延长洗脱时间,所以选择2.5mL/min左右作为最佳的洗脱流速。图19不同流速下的洗脱曲线Fig.19EffectoftheflowrateoflysineontheElutioncurves4152.3.2树脂的耐久性实验结果图20是用同一根树脂吸附柱连续进行10次动态吸附实验的平衡吸附量的柱状图。由图可以看出,每次实验的平衡吸附量基本相同,说明001×7型树脂的吸附性能在使用了10次后基本不变,适用于赖氨酸的连续分离操作。420图20树脂的连续使用性能Fig.20Thecontinuoususedcapabilityof001×73结论本文给出了离子交换树脂法吸附分离赖氨酸的静态和动态过程的影响因素和最优条-20-
中国科技论文在线http://www.paper.edu.cn件。采用强酸性阳离子交换树脂分离赖氨酸,筛选出最优树脂为001×7型,吸附能力为4250.0751g/g,解吸率96.33%。探究了影响树脂静态吸附能力的因素,最佳吸附条件为:赖氨酸溶液体积100mL,pH为3.5-4.5,吸附时间2h,吸附能力最高可达0.09g/g湿树脂。以氨水溶液作为解吸剂,探究了影响静态解吸率因素,最佳解吸条件为:氨水浓度1mol/L,体积为100mL,解析时间4h,解吸率最高为96.8%。此最佳静态吸附和解吸条件为后续动态吸附提供了数据参考。同时,研究了吸附平衡等温线,证明整个吸附过程更加符合Langmuir430等温吸附过程,属于单分子层吸附。分别探究了温度、pH对树脂吸附动力学的影响,表明假二级吸附动力学模型能够很好的模拟赖氨酸吸附过程。探究了影响树脂动态吸附解吸赖氨酸的因素,最优条件为:上样浓度25g/L-40g/L,上样流速2.5mL/min,上样体积400-500mL,洗脱流速2.5mL/min左右。435[参考文献](References)[1]徐昌洪,方家骥.连续离子交换色谱分离在赖氨酸精制过程中的应用[J].应用科技,2008,16(20):18-20.[2]廉少杰,张伟国.梯度温度法提高L-赖氨酸发酵水平的研究[J].食品工业科技,2012,8:242-251.[3]王均成,王文风.L-赖氨酸发酵生产研究进展[J].发酵科技通讯,2010,39(4):39-43.[4]王磊,李宗林等.L-赖氨酸快速发酵新菌种及工艺研究[J].氨基酸和生物资源,1995,17(3):1-5.440[5]张军华.微生物发酵法生产L-赖氨酸的研究进展[J].生物加工过程,2012,10(2):73-78.[6]BinTan,GuangshengLuo,JiadingWang.Enantioseparationofaminoacidsbyco-extractantswithdi(2-ethylhexyl)phosphoricacidandtartaricacidderivatives[J].Tetrahedron:Asymmetry,2006,17:883-891.[7]AmpoothiriK,Madhavan,PandeyA.FermentationandRecoveryofL-glutamicacidfromCassavaStarchHydroly-sateByIon-exchangeResinColumn[J].RevistadeMicrobiologia,1999,30(3):258-264.445[8]ClovisSacardodaSilva1,MaressaFabianoCuel,etal.Separationofclavulanicacidfromfermentedbrothofaminoacidsbyanaqueoustwo-phasesystemandion-exchangeadsorption[J].NewBiotechnology,2012,29(3):428-431.[9]YapingZhang,YanChen,MingzhuYue.RecoveryofL-lysinefromL-lysineMonohydrochloridebyIonSubstitutionUsingIon-exchangeMembrane[J].Desalination,2011,271(1):163-168.450[10]李强.基于原位分离的新型丁二酸发酵过程[D].北京:中国科学院研究生院,2010.[11]唐涛.氨基酸柱前衍生化HPLC方法发展及应用[D].南京:南京理工大学,2006.[12]赵文惠,曾诚等.高效液相-示差折光法比较新疆地产8种蜂蜜中4种糖的含量[J].食品安全质量检测学报,2015,6(10):4193-4198.[13]刘洪亮,张念洁等.HPLC示差折光分析法测定人参果蔬发酵饮料中果糖、葡萄糖、蔗糖含量[J].轻工455标准与质量,2014,6:54-55.[14]周勇.赖氨酸发酵清液pH值对离子交换树脂吸附的影响[J].粮食与食品工业,2014,21(1):15-17.[15]FernandoBautistaL.,Jose´Pinillaetal.AdsorptionIsothermsofAspartameonCommercialandChemicallyModifiedDivinylbenzene-StyreneResinsatDifferentTemperatures[JJournalofChemicalandEngineeringData,2002,47:620-627.460[16]NamasivayamC,SumithraS.AdsorptiveRemovalofCatecholonWasteFe(III)/Cr(III)Hydroxide:EquilibriumandKineticsStudy[J].Industrial&EngineeringChemistryResearch,2004,43:7581-7587.[17]FrancoisRenault,etal.Cationizedstarch-basedmaterialasanewion-exchangeradsorbentfortheremovalofC.I.AcidBlue25fromaqueoussolutions[J].BioresourceTechnology,2008,99:7573-7586.[18]HoYS,MckayG.TheKineticsofSorptionofDivalentMetalIonsOntoSphagnumMossPeat[J].Water465Research,2000,34(3):735-742.-21-'
您可能关注的文档
- 模拟移动床色谱分离4-苯基噁唑烷-2-硫酮对映体.pdf
- 氧化三甲胺在细胞超低温冻存中的应用.pdf
- 汽车节能驾驶辅助优化研究.pdf
- 波纹钢板剪力墙简化模型分析.pdf
- 温拌沥青混凝土感应加热自愈合性能研究.pdf
- 生物质炭不同施用量对设施菜地N2O及NOx排放的减排效应研究.pdf
- 电化学类芬顿(Electro-Fe2+EDTA)体系降解染料废水研究.pdf
- 石墨烯负载铁酸锌纳米材料的制备及应用.pdf
- 硫辛酸包埋物制备工艺优化及其抗氧化性研究.pdf
- 科技成果转化下农业专业技术人员对继续教育的认知态度、参与行为及其需求意愿分析--基于福建、安徽、山东和黑龙江四省的问卷调查.pdf
- 空冷支架结构体系抗震性能试验研究.pdf
- 竞争环境下考虑消费者行为的预售策略研究.pdf
- 纯扭作用下型钢混凝土构件极限承载力计算.pdf
- 绿色创新与企业财务绩效:资源松弛与环境动荡性的调节作用.pdf
- 绿色创新的驱动力一个文献综述.pdf
- 考虑异质车辆的生产与运输计划整合研究.pdf
- 身体攻击、关系攻击的共同性与差异性:意志控制与性别的作用.pdf
- 轮毂电机驱动电动汽车差动助力转向与横摆稳定性联合控制.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明